Nacional
Canetas emagrecedoras: Brasil tem 6 mortes suspeitas por pancreatite
Registros envolvem medicamentos usados contra obesidade e diabetes e seguem em análise técnica
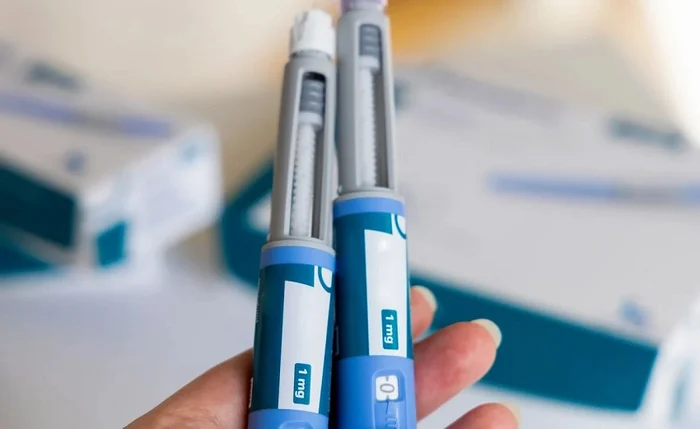
A Agência Nacional de Vigilância Sanitária (Anvisa) monitora seis mortes suspeitas e ao menos 225 notificações de pancreatite possivelmente associadas ao uso de medicamentos conhecidos como canetas emagrecedoras no Brasil. Os dados constam no sistema VigiMed e em registros de estudos clínicos realizados desde 2018.
Os casos envolvem fármacos da classe dos agonistas do GLP-1, utilizados no tratamento de obesidade e diabetes tipo 2, entre eles semaglutida, liraglutida, dulaglutida, lixisenatida e tirzepatida. As notificações no país se concentram em São Paulo, Paraná, Bahia e Distrito Federal, enquanto as mortes não tiveram a localização divulgada.
O tema ganhou repercussão internacional após autoridades sanitárias do Reino Unido divulgarem um alerta no início deste mês, informando 19 óbitos associados a quadros de pancreatite em usuários desses medicamentos. A Anvisa esclarece que, no Brasil, todos os registros ainda passam por avaliação técnica e não representam confirmação de causalidade.
Especialistas apontam que o número de ocorrências pode ser maior, já que a notificação de pancreatite não é compulsória. Dessa forma, hospitais e profissionais de saúde não são obrigados a comunicar todos os casos à agência reguladora.
Na base do VigiMed, os registros estão relacionados a medicamentos comercializados sob marcas como Ozempic, Wegovy, Saxenda, Victoza, Trulicity, Mounjaro, Rybelsus, Xultophy e outras. A Anvisa ressalta que parte das notificações envolve suspeita de uso de produtos irregulares, falsificados ou manipulados, o que dificulta a análise individual dos episódios.
Segundo médicos ouvidos pela agência, o risco de pancreatite já é conhecido e está descrito em algumas bulas. No caso da tirzepatida, por exemplo, a inflamação do pâncreas aparece como reação adversa incomum. Além disso, muitos usuários desses medicamentos pertencem a grupos com fatores de risco prévios, como obesidade e diabetes.
O presidente da Sociedade Brasileira de Endocrinologia e Metabologia (SBEM), Alexandre Hohl, destaca que o tratamento deve ocorrer com acompanhamento médico regular, incluindo monitoramento clínico conforme os protocolos. Ele também chama atenção para o uso sem prescrição, especialmente de versões manipuladas, que não passam por controle de dose nem avaliação individual.
Estimativas do setor indicam que o mercado ilegal desses medicamentos movimenta cerca de R$ 600 milhões por ano no Brasil. Em escala global, há mais de 14 mil notificações de pancreatite e 378 mortes associadas ao uso desses fármacos.
Como resposta aos dados, a Anvisa passou a exigir retenção de receita médica na venda desses medicamentos a partir de abril de 2025. A agência informou que a medida busca reforçar a avaliação prévia dos pacientes e não descarta novas ações regulatórias, caso surjam evidências adicionais de risco.
As farmacêuticas Eli Lilly e Novo Nordisk informaram que acompanham os registros e ressaltaram que a pancreatite é um evento descrito nas bulas de seus produtos. Ambas orientam que o uso seja interrompido diante de suspeita de reação adversa, com procura imediata por atendimento médico.





